RQS Med consulting e le funzionalità di EUDAMED la banca dati europea dei dispositivi medici
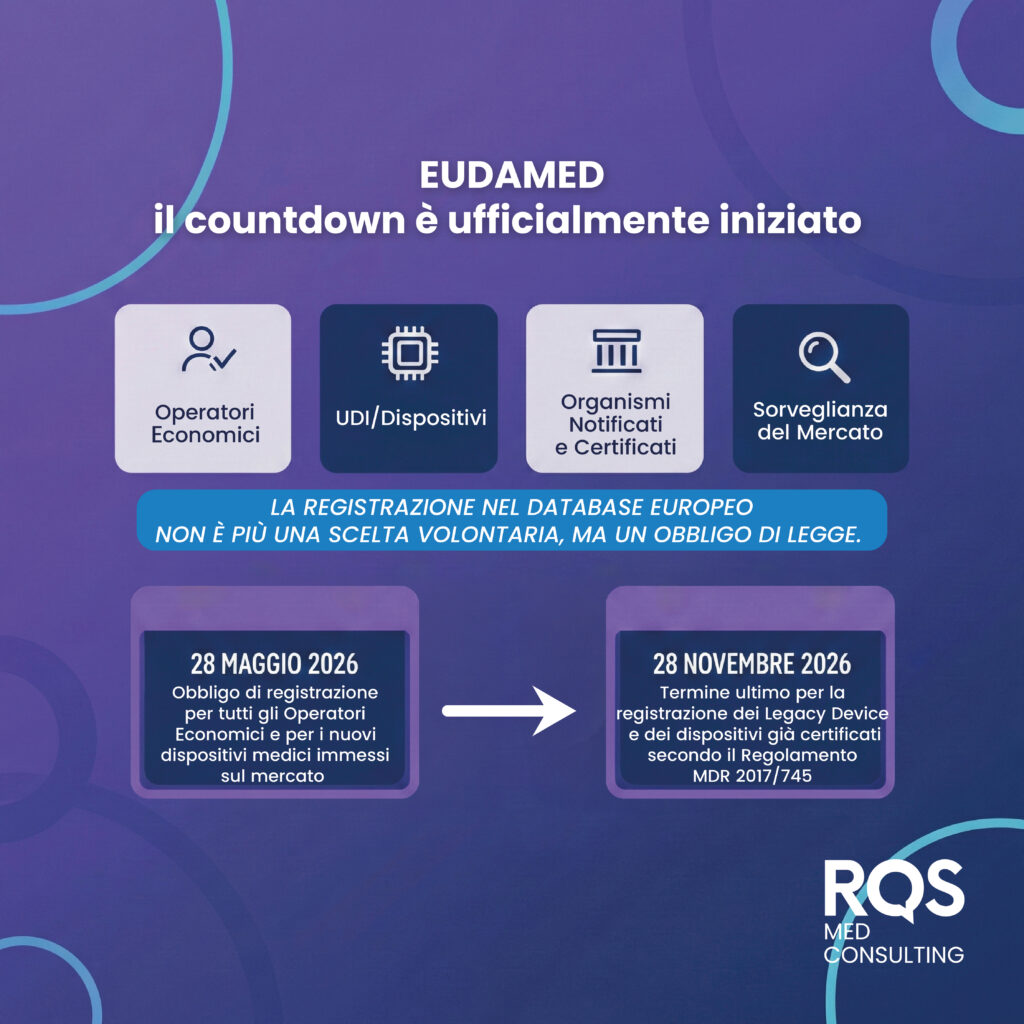
Il 27 novembre 2025, con la pubblicazione in Gazzetta Ufficiale della Decisione (UE) 2025/2371, la Commissione Europea ha dichiarato la piena funzionalità dei primi quattro moduli di EUDAMED, la banca dati europea dei dispositivi medici:
✔️Attori / Operatori economici
✔️UDI/Dispositivi
✔️Organismi Notificati e Certificati
✔️Sorveglianza del Mercato
Siamo di fronte a un vero punto di svolta: l’inserimento dei dati in EUDAMED non è più una scelta volontaria, ma un obbligo di legge.
Per i fabbricanti, il countdown è ufficialmente iniziato con due deadline da segnare in calendario:
– 28 Maggio 2026: scatta l’obbligo di registrazione per tutti gli Operatori Economici (fabbricanti, mandatari e importatori) e per i nuovi dispositivi medici immessi sul mercato.
– 28 Novembre 2026: termine ultimo per la registrazione dei Legacy Device (ai sensi della Direttiva 93/42/CEE) e dei dispositivi già certificati secondo il Regolamento MDR 2017/745.
La complessità di EUDAMED non risiede solo nel caricamento tecnico dei dati, ma nella corretta interpretazione dei requisiti regolatori per evitare blocchi commerciali o non conformità.
In questo scenario, il tempo è la risorsa più preziosa. Come partner strategico, RQS Med consulting supporta le aziende del settore nel governare l’intero processo di adeguamento: dalla verifica della documentazione tecnica alla gestione operativa dei moduli EUDAMED, garantendo una transizione fluida e sicura verso la piena compliance.
Contatta RQS Med consulting per una consulenza dedicata: definiscono il tuo piano d’azione per EUDAMED.
