RQS Med consulting e il modulo UDI/Devices della Banca Dati Europea EUDAMED
Il modulo UDI/Devices della Banca Dati Europea EUDAMED rappresenta molto più di un semplice database: si tratta di un sistema gerarchico strutturato in cui la correttezza dei dati inseriti determina la conformità del dispositivo secondo i Regolamenti (UE) 2017/745 e 2017/746.
Il passaggio dai database nazionali a questa piattaforma centralizzata ha modificato profondamente l’approccio alle registrazioni. Non si ragiona più per codici prodotto (REF), ma per identificativi univoci del dispositivo (UDI).
Questo cambiamento richiede una conoscenza precisa della relazione tra BASIC UDI-DI e UDI-DI associati ai singoli dispositivi, e delle loro implicazioni sulla documentazione tecnica, sul ciclo di vita e sulla tracciabilità del prodotto.
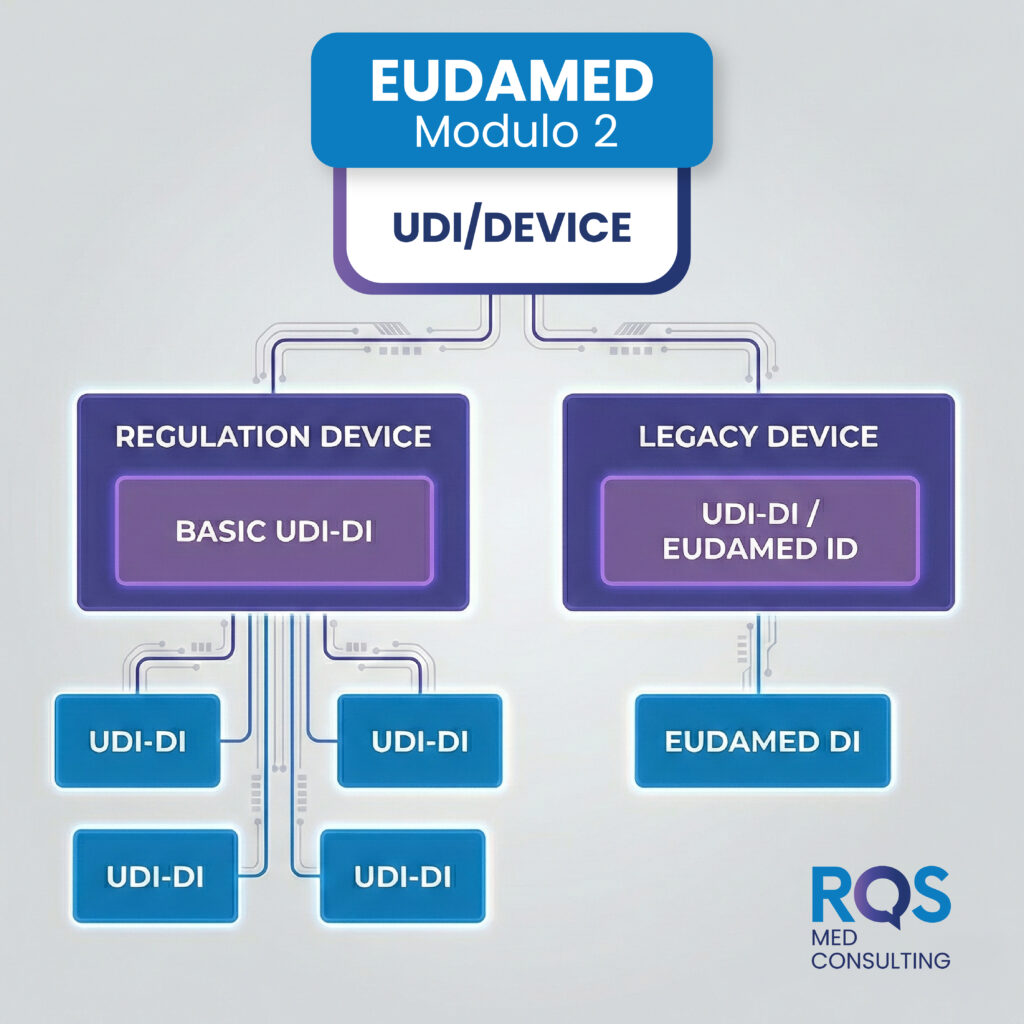
Le registrazioni in EUDAMED seguono modalità differenti a seconda della legislazione di riferimento:
✔️Regulation Device (MDR/IVDR): la struttura è gerarchica e rigorosa; si parte dalla registrazione del BASIC UDI-DI di una determinata famiglia di dispositivi, cui vengono poi collegati i singoli UDI-DI.
✔️Legacy Device (MDD/IVDD): la logica qui è diversa poiché non si procede per famiglia, ma attraverso l’assegnazione a ogni identificativo univoco di nuovi identificativi generati dalla banca dati Europea (EUDAMED ID ed EUDAMED DI).
Questa duplice architettura genera complessità operative che richiedono competenze specifiche per essere gestite in modo conforme ed efficiente.
RQS Med consulting affianca i fabbricanti nella gestione strutturata delle registrazioni in EUDAMED, garantendo coerenza normativa e operativa in ogni fase del processo.
Trasforma la complessità di EUDAMED in un vantaggio competitivo. Contatta RQS a info@rqsmedconsulting.com
