- News
- Il Distretto
- Aziende
arrow_drop_down
- Fornitori Specializzati
- Cerco Lavoro
arrow_drop_down
- Pubblicazioni
arrow_drop_down
- Gallery
- Contatti

La Commissione Europea ha annunciato il rinvio dell’entrata in funzione del database europeo sui dispositivi medici (EUDAMED) e un nuovo aggiornamento della tempistica di sviluppo della piattaforma stessa.
È di un anno il ritardo previsto sui passaggi rimanenti, richiesti per la piena funzionalità e applicabilità di EUDAMED. Si tratta di informazioni cruciali per gli operatori economici, poiché gli obblighi di registrazione relativi a EUDAMED diventano ora pienamente cogenti per la funzionalità completa di EUDAMED stesso.
Nuova progettazione di EUDAMED
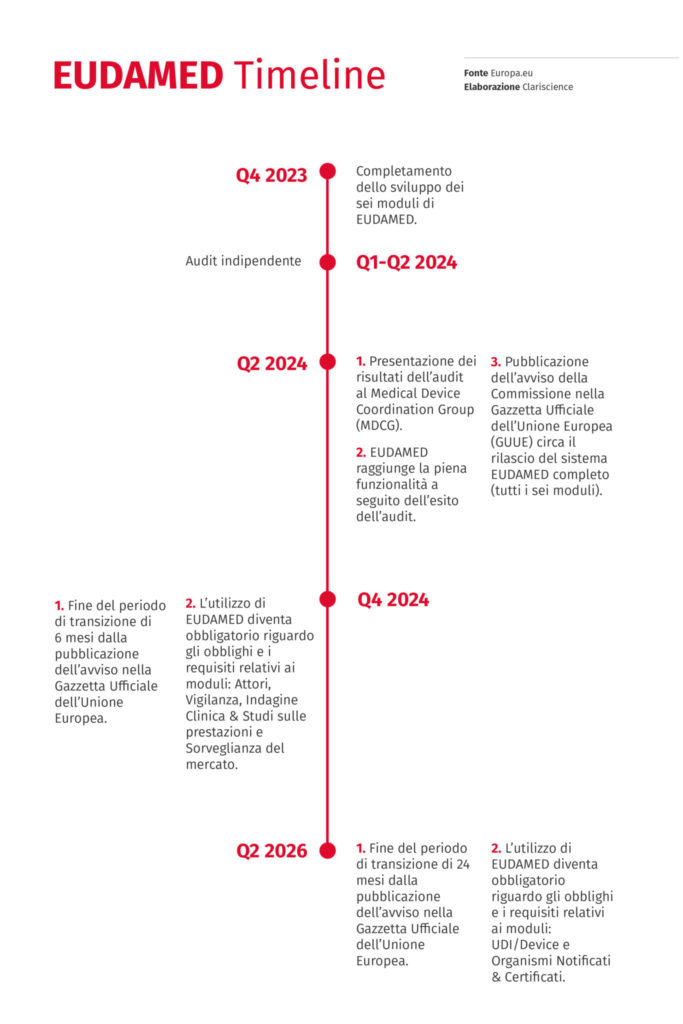
Il completamento del processo di sviluppo dei moduli nel database è stato posticipato al terzo trimestre del 2024. Nella nuova timeline emessa, i moduli non ancora attivi (vigilanza, indagine clinica e sorveglianza del mercato) dovranno essere incorporati nel database alla fine del 2023. La previsione precedente indicava che tutti i moduli sarebbero stati accessibili nel quarto trimestre del 2022.
Inoltre, nel primo semestre del 2024 sarà condotto un audit su EUDAMED. Successivamente, il Medical Device Coordination Group valuterà i risultati dell’audit. Se saranno positivi, la Commissione pubblicherà un avviso nella Gazzetta ufficiale dell’Unione Europea, che porterà al rilascio del sistema EUDAMED completo; in quel momento EUDAMED diventerà pienamente funzionante.
Dopo la pubblicazione dell’avviso nella GUUE, saranno attivati periodi transitori. L’uso di EUDAMED diventerà obbligatorio 6 mesi dopo la pubblicazione dell’avviso sulla GUUE per i requisiti relativi a:
- attori
- vigilanza
- indagine clinica e studi sulle prestazioni
- sorveglianza del mercato
Per le aree indicate qui sotto, l’uso di EUDAMED diventerà obbligatorio 24 mesi dopo la pubblicazione dell’avviso della GUUE:
- UDI/Device
- Organismi Notificati
- Certificati
La situazione in Italia
Il quadro è quello dell’utilizzo volontario. Il fabbricante può registrarsi e chiedere il rilascio del Single Registration Number (SRN).
Inoltre, come da articolo 123 comma d del Regolamento 745/2017, fino a quando EUDAMED non sarà pienamente operativo, le corrispondenti disposizioni delle Direttive 90/385/CEE e 93/42/CEE continueranno a venire applicate al fine di ottemperare gli obblighi previsti. Rimane l’obbligo di adempiere alla registrazione nella banca dati nazionale.
La Circolare del 12 novembre 2021 del Ministero della Salute chiarisce alcuni aspetti necessari all’applicazione del Regolamento, tra i quali: disposizioni in materia di banca dati nazionale, i fabbricanti di dispositivi nazionali, i legacy device, gli organismi notificati, la pubblicità, il ricorso a norme armonizzate, i prodotti dell’allegato XVI del Regolamento, le tariffe e le sanzioni.
La Circolare ha lo scopo di garantire un’applicazione uniforme e consistente del Regolamento sino al pieno funzionamento di EUDAMED e durante il periodo di validità delle marcature CE ai sensi delle Direttive”.
Nel prossimo futuro verrà emanato un decreto di adeguamento della normativa italiana al dettato del Regolamento per la disciplina degli aspetti di interesse sanitario, dalle indagini cliniche fino alle attività di sorveglianza post-commercializzazione, vigilanza e sorveglianza del mercato (previsto dall’Art.15 della Legge 22 aprile 2021 n. 53), che è stato approvato in via preliminare dal Consiglio dei Ministri il 5 maggio scorso.
Qui sotto trovi la timeline che riassume tutti gli step di sviluppo di EUDAMED, fino al suo completo funzionamento.
Fonte: europa.eu – https://bit.ly/3RyQYZL