Silicone & Specialties: “Sistema UDI, marcatura dei dispositivi medicali”
L’introduzione del sistema UDI (Unique Device Identification), previsto dai Regolamenti UE 2017/745 (MDR) e 2017/746 (IVDR), garantisce la tracciabilità univoca e la gestione integrata dei dispositivi medicali.
Tale sistema consente di associare a ciascun dispositivo un identificativo unico e standardizzato, migliorando la sicurezza, la gestione e l’efficienza operativa.
✔️ La struttura del sistema UDI
Il sistema UDI si articola in due componenti principali:
UDI-DI (Device Identifier): un codice statico, assegnato dal produttore, che identifica univocamente il modello o la famiglia di dispositivi. È fondamentale per la classificazione e la gestione tecnica del prodotto.
UDI-PI (Production Identifier): codice dinamico che include informazioni variabili legate al processo produttivo, quali numero di lotto, numero di serie, data di produzione o scadenza. È cruciale per la rintracciabilità a livello di singolo dispositivo.
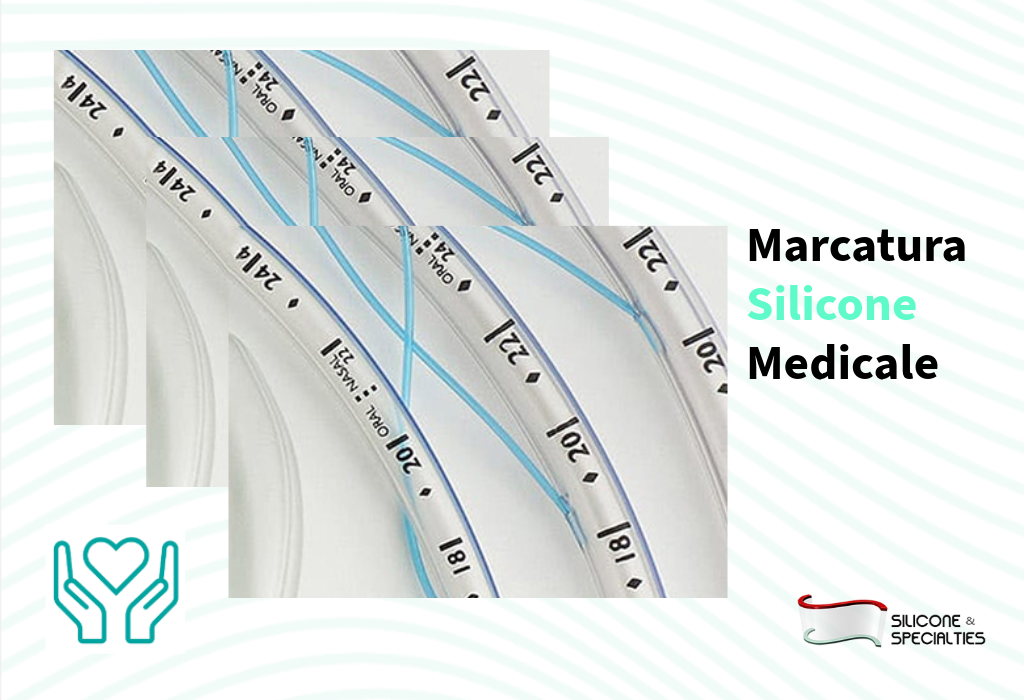
✔️ La marcatura
La marcatura UDI deve essere applicata in conformità agli standard internazionali, garantendo leggibilità sia in formato HRI (Human Readable Interpretation) sia in formato AIDC (Automatic Identification and Data Capture), tipicamente tramite codici a barre lineari o Data Matrix 2D.
I Regolamenti MDR e IVDR, prevedono obblighi specifici per i produttori che sono tenuti a:
1) assegnare un UDI a ciascun dispositivo e livello di confezionamento;
2) apporre la marcatura UDI sull’etichetta e, quando richiesto, direttamente sul dispositivo (direct marking), in particolare per dispositivi riutilizzabili;
3) registrare i dati UDI nel sistema EUDAMED, la banca dati europea per la sorveglianza e la gestione post-market, la cui piena operatività è prevista entro il 2025.
✔️ Le scadenze
Le scadenze per l’adozione del sistema UDI sono differenziate in base alla classe di rischio https://www.silicones.it/it/news-approfondimento/37/UDI-codice-univoco-identificazione-dispositivi-medicali
✔️ I processi
L’adozione del sistema UDI ha imposto una revisione strutturale dei processi di produzione, etichettatura e gestione dati, in particolare, si è reso necessario integrare i sistemi di codifica e marcatura conformi agli standard riconosciuti, garantendo la durabilità e la leggibilità dei codici anche in condizioni di sterilizzazione e uso clinico.
Presso il loro stabilimento produttivo Sterne Exsto Group abbiamo attrezzato una camera bianca ISO 6 con un efficiente sistema di marcatura laser per dispositivi medicali in silicone.
Per approfondimenti su marcatura laser e tampografia https://www.silicones.it/it/marcatura-silicone
